電気,化学
---------------------------目次---------------------------豆電球/電磁石
フレミングの左手/電磁誘導
右ねじの法則/方位磁針のふれ
電熱線/水溶液
気体/化学変化
燃焼
--------------------------------------------------------
電気
回路の電流・電圧
電池を導線に繋ぐと電流が流れる。電流値は電子の量。電圧を電子のスピードだとイメージされる。
中学内容では電流値をA[アンペア]や電圧値をV[ボルト]、抵抗値をΩ[オメガ]とする。
(電池1つと直列の電池2つを並列した回路は故障するため、高校入試にはでない。)
豆電球(抵抗)を直列に繋いだ回路を考える。
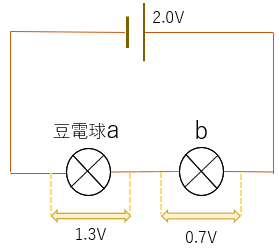
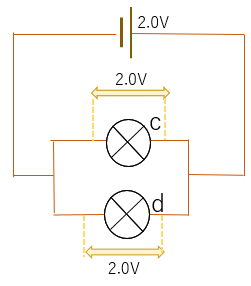
例題1:

2.5-0.6=1.9(V)
答え.1.9V
例題2:

答え.1.5V
例題3.
電圧値X,Yを求めなさい。
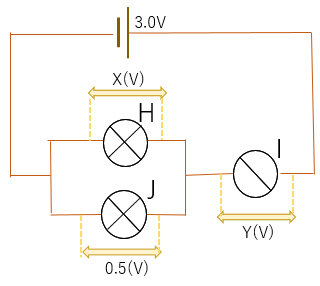
解答(1)豆電球HとJは並列回路なのでX(V)=0.5(V)
3.0=0.5+Y(V)
→Y(V)=2.5(V)
中学内容ではオームの法則などの公式により電流A[アンペア]や電圧V[ボルト]、抵抗Ω[オメガ]、合成抵抗値を簡単に求められる。
電圧V=電流I×抵抗R
電流は電圧と抵抗によって決まる。
上記のV=IRをオームの法則という。
例題4
回路に流れる電流(A)を求めなさい。
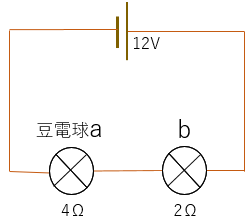
まずは合成抵抗を計算する。
豆電球は直列なので合成抵抗は4Ω+2Ω=6Ω
V=IRの式にV=12(V)とR=6Ωを代入すると
12=I×6
I=2A
答え.2A
例題5
(1)点Mに流れ込む電流値(A)を求めなさい。
(2)豆電球Kと豆電球Lに流れ込む電流値をそれぞれ求めなさい。
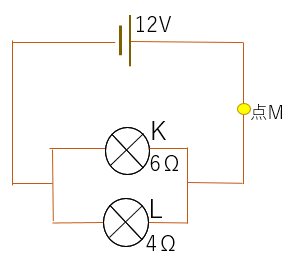
まずは合成抵抗を計算する。
(1)
=+
=+
=
=
R=2.4(Ω)
V=IRの式にV=12(V)とR=2.4(Ω)を代入すると
12=I×2.4
I=5(A)
(2)点Mには5Aの電流が流れている。
豆電球KとLの抵抗値は6:4=3:2のため。
KとLに流れ込む電流の比は逆比の2:3
答え.豆電球Kには2A,Lには3Aの電流が流れる。
電磁石
フレミング左手の法則と右ねじの法則を記憶しておけば大幅に加点が期待できる。右ねじの法則
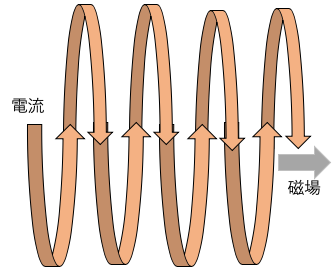
↑電流が奥から手前に流れているために、
右手を奥から手前に円状にすると親指が右を向く
これが磁場の方向である。
電流と磁場を逆にしても同様である。↓
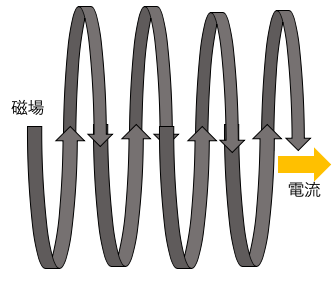

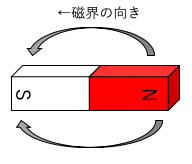
↓磁界はN極からS極に向かう。
方位磁針のふれ
磁針と平行に導線を設置し、電流を流した場合、導線を右手と方位磁針で挟み、親指の方向にN極がふれる。
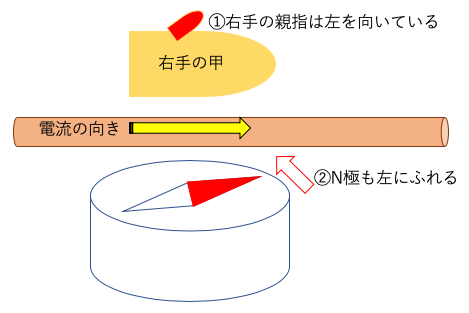
または、以下のように右回りに磁界が発生するので、
磁界の方向にN極が向くと解釈しても良い。
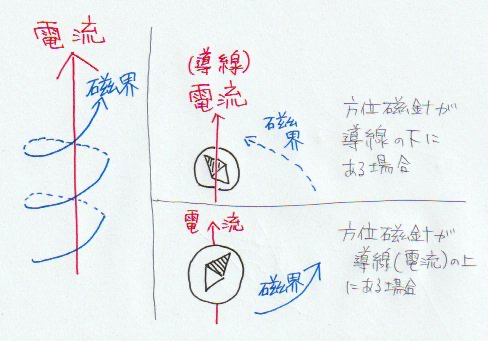
右回り:右側で下(奥)に進み、左側で上(手前)に進む。
例題:以下の方位磁針A,Bの針のN極が左右どちらに動くか、それとも動かないか答えよ。
(動画と同じ問題です)
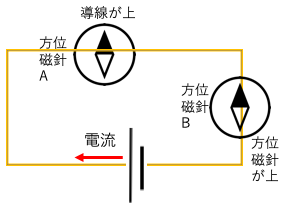
解答
A:🧭と導線を上から右手で挟むと親指が北側を向くため、N極の針は動かない。
B:🧭と導線を右手で下から挟むと親指が西側を向くため、N極の針は左に触れる。
電磁誘導
1.N極を近づける場合。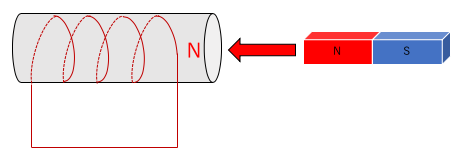
近づけたN極に反発するために電磁石の右側がN極になる。
右ねじの法則に従って電流が流れる。
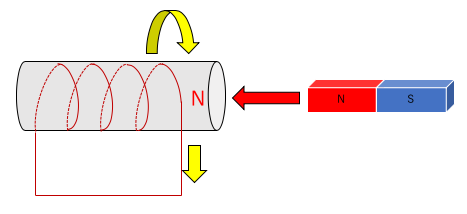
2.N極を離す場合。
離れていくN極を引く戻すために電磁石の右側がS極になる。
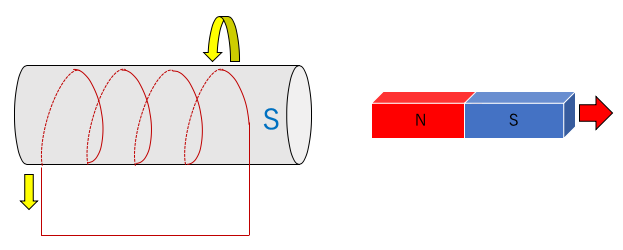
3.(N極を離す場合で)巻き方を逆にする場合。
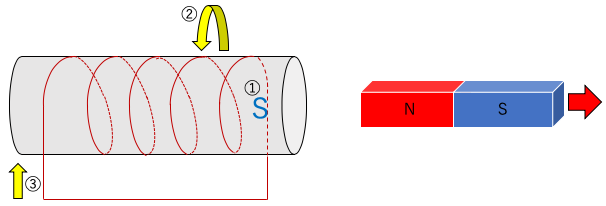
①N極が離れていくので、磁石を引く戻すために①の部分がS極になる。
②右側がS極になり、右ねじの法則より右手親指が左向きになる。
③磁石から電磁石を見ると右回りになるので、③の方向に左から電流が流れる。
フレミング左手の法則
フレミング左手の法則は電流、磁力、力の働く方向を特定できる便利な法則。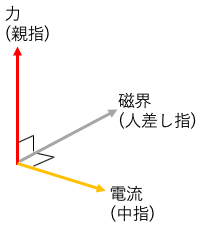
水溶液
-------------------------アルカリ性↓---------------------------水酸化ナトリウム水溶液(NaOH):水酸化ナトリウム(個体):アルミニウムを溶かす。
重曹(そう)水:炭酸水素ナトリウム(個体:NaHCO3):強い酸性の水溶液に入れると二酸化炭素を溶かす。
アンモニア水:アンモニア(気体:NH3):加熱するとアンモニアを発生。
石灰水:水酸化カルシウム(CaOH)の水溶液:二酸化炭素を石灰水通すと白く濁る(炭酸カルシウム[CaCO3]が発生)。
-------------------------中性↓---------------------------
アルコール水:アルコール(液):消毒に使用。炭素を含み電気を通さない。
(備考:アルコール:C2H6O)
砂糖水:砂糖(固):加熱時に焦げる。炭素を含み電気を通さない。
(備考:砂糖:C12H22O11)
食塩水:食塩(塩化ナトリウム[NaCl]):炭素を含まず電気を通す。
-------------------------酸性↓-------------------------
塩酸:塩化水素(HCl)[気]の水溶液:鉄、アルミニウム両方溶かす。
炭酸水:炭素(H2CO3の水溶液)[気]:石灰水を混ぜると白く濁る。
す[酢]:さく酸[酢酸:CH3COOH][液]:卵の「から」を溶かす。
----------------------------------------------------
気体
空気の重さ
空気の重さ(空気を1.0倍とする)塩素(2.5)>二酸化炭素(1.5)>塩化水素(1.3)>酸素(1.1)>
空気(1.0)>
ちっ素(0.97)>アンモニア(0.6)>メタン(0.56)>水素(0.07)
気体の集め方
基本的には気体は水上置換法(水素、酸素)で集める。水に溶けてしまう気体を仕方なく下方置換法(二酸化炭素、塩素、塩化水素)、上方置換法(アンモニア)
薄めた塩酸50cm2に薄めた水酸化ナトリウム水溶液
を混ぜ合わせ各ビーカーA,B,C,D,Eに水溶液を作った。
ムラサキキャベツの汁を加えるとCが紫色になった。
各ビーカーA-Eに入れた水酸化ナトリウムの量は以下の通り。
A:水酸化ナトリウム20ml
B:水酸化ナトリウム40ml
C:水酸化ナトリウム60ml
D:水酸化ナトリウム80ml
E:水酸化ナトリウム100ml
(1)鉄が溶けて気体が発生する水溶液はA〜Eのうちどれか?
(2)塩酸150mlと水酸化ナトリウム170mlを混ぜた水溶液は何性か?

-------------------解答-----------------------
(1)答え:A,Bが鉄を溶かす。発生する気体は酸性。
A,Bが塩酸のためA,Bは鉄を溶かすことができる。
塩酸はHClであり、Hの水素が発生する。
(2)答え:酸性。
塩酸水溶液と水酸化ナトリウム水溶液が中性になる割合はこの問題では5:6
塩酸水溶液150mlと水酸化ナトリウム180mlを混ぜたときに中性になるため。
(2)の問題の水溶液は塩酸が多いため酸性。
ムラサキキャベツの汁の色の動画↓
化学変化
水に硫酸銅や水酸化ナトリウムを入れて水に電流を流すと、水の組成式がH2Oであるため、
水素と酸素が2:1の割合で発生する。
(参考:水がH2Oの組成のため。H:水素原子,O:酸素原子)
燃焼
金属を熱して加熱すると金属の重さと熱してできた酸化物の重さを調べると同じ比になる。銅と酸素は4:1の割合の質量比で常に反応する。
酸素とマグネシウムは2:3の質量比で常に反応する。
例題(燃焼):銅5.0gを燃やすと酸化銅が8.0gできた。
酸化銅が10.0gできたとき、燃やした銅は何gか?

------------例題(燃焼)解答--------------
銅:酸化銅=5:8より求める銅の重さをxgとすると
x:10=5:8
→8x=50(出し方:内項=外項を用いた)
→8x÷8=50÷8
→x=6.25(g)
元の銅の重さは6.25g答え
---------------------------目次---------------------------
回路の電流と電圧/電磁石
フレミングの左手/電磁誘導
右ねじの法則/方位磁針のふれ
電熱線/水溶液
気体/化学変化
燃焼
--------------------------------------------------------
Short Notes
Homeに戻る